golfmechanisch atoommodel
Schrödingervergelijkingen
Het atoommodel van Bohr werd verfijnd met en magnetische niveau's. Maar ook dit model geeft nog geen verklaring voor eigenschappen zoals de ruimtelijke structuur van moleculen. De kwantummechanica verving begin 20e eeuw het klassieke beeld van schillen en elektronen op vaste banen door onzekerheid, statistiek en golfvergelijkingen.
Schrödinger beschreef de beweging van elektronen door golfvergelijkingen. Voor elk elektron in een atoom kan je een unieke schrödingervergelijking opstellen. Met deze vergelijking kan je punten in een x,y,z-assenstelsel berekenen. Deze punten geven informatie over de waarschijnlijkheid dat het elektron zich op een bepaalde plaats in het atoom bevindt. Bereken je een groot aantal punten, dan krijg je een stippendiagram.
contourlijnen en orbitalen
Gebieden met 90% kans om een elektron aan te treffen bakende Schrödinger af met contourlijnen. De gebieden noemde hij orbitalen.
De vroegere s, p, d en f- subschillen verschijnen nu opnieuw, maar dan als orbitalen met een eigen typische vorm. Maar onthou dat een orbitaal geen bestaand object is, wel een denkbeeldig gebied, bepaald door een waarschijnlijkheid van 90% om er een bepaald elektron aan te treffen.
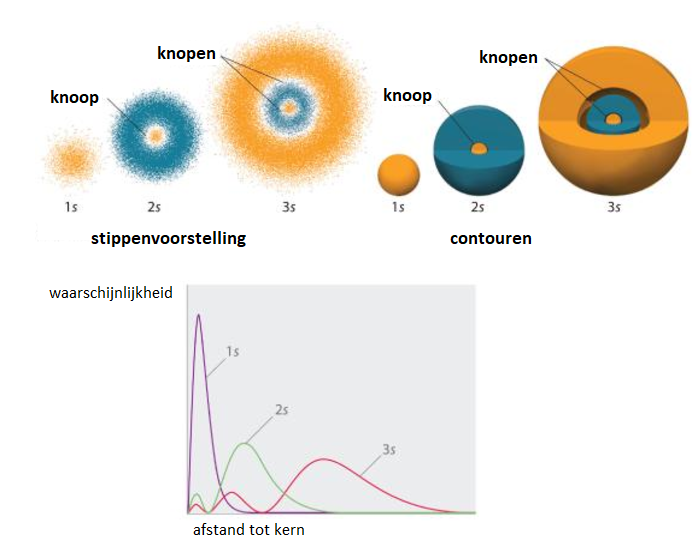
s- orbitaal
Een s-orbitaal is bolvormig.
Een bol heeft slechts één oriëntatie in een magnetisch veld.
Het s-magnetisch niveau wordt daarom niet opgesplitst.
p-orbitaal
Een p-orbitaal is haltervormig. Het knooppunt van de halter valt samen met de atoomkern.
x-, y- en z-as geven 3 mogelijke oriëntaties. Daarom wordt het p-orbitaal opgesplitst in 3 oriëntatiemogelijkheden.
d-orbitaal
De vorm van een d-orbitaal is niet eenduidig.
Een vorm met vier lobben rond de atoomkern heeft vier mogelijke oriëntaties.
Een vijfde vorm heeft naast een haltervorm ook nog een torus.
Dat brengt het aantal orëntatiemogelijkheden op vijf.
f-orbitaal
Een f-orbitaal heeft naast zes mogelijke orïentaties van 6 lobben rond een atoomkern nog
een vorm met twee lobben en twee torussen, wat het totaal op 7 brengt.