ionstraal
vorming van ionen
- Onttrek je elektronen aan een atoom, dan ontstaat een positief geladen ion (kation).
- Voeg je elektronen aan een atoomtoe, dan ontstaat een negatief geladen ion (anion).
- Een positief geladen ion (kation) heeft een kleinere straal dan het overeenkomstige neutrale atoom. Het onttrekken van elektronen veroorzaakt een overschot aan kernlading, waardoor de straal kleiner wordt. Bijvoorbeeld: de atoomstraal van natrium = 186 pm, de ionstraal maar 102 pm.
- Een negatief geladen ion (anion) heeft een grotere straal dan het overeenkomstige neutrale atoom. Door de bijkomende negatieve lading ontstaat een grotere afstoting tussen de atomen, zodat de straal groter wordt. Bijvoorbeeld: de atoomstraal van fluoride = 72 pm, de ionstraal 136 pm.
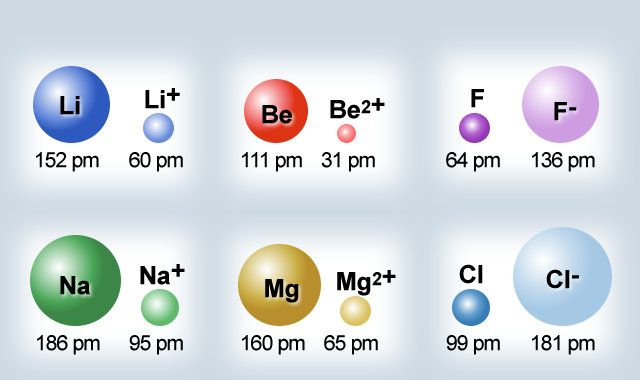
Binnen een periode
- neemt van links naar rechts de ionstraal van positieve ionen met dezelfde elektronenconfiguratie af.
- neemt van links naar rechts de ionstraal van positieve ionen met dezelfde elektronenconfiguratie toe.